荧光共定位分析是对细胞中两种带有荧光标记的蛋白、细胞器或者药物、纳米材料等之间的空间相互位置关系进行分析,以确定它们是否定位于同一区域或存在相关性,在细胞生物学、药理学、医学、植物学等研究领域具有广泛的应用。
最直观最简单的共定位分析就是直接看不同颜色的荧光之间是否重叠,比如蛋白A标有绿色荧光,蛋白B标有红色荧光,如果蛋白A和B共定位则绿色红色叠加显示为黄色(图1)。只是这种方式无法提供准确的定量结果,已无法满足科研工作者越来越高的要求。所以我们需要可以提供量化结果的更专业的共定位分析。

LAS X软件作为Leica显微成像系统的搭载平台,不仅能够提供完美的成像质量,而且整合了众多高级应用并具有强大的后期数据处理分析功能,包括FRAP功能、FRET功能,图像2D、3D测量与自动分析功能,当然也有共定位分析功能Colocalization analysis,且操作非常简单,下面我们就来看看徕卡的共定位分析怎么做吧!
1 进入Quantify

2 在Tools中选择Colocalization
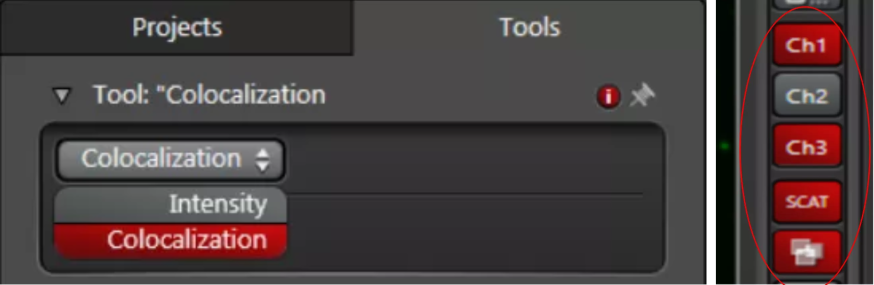
共定位分析是对两个荧光通道之间进行分析,所以对于通道数多于两个通道的数据,需要先确定分析哪两个,把暂不分析的通道点灰,即可得到共定位结果及散点图。
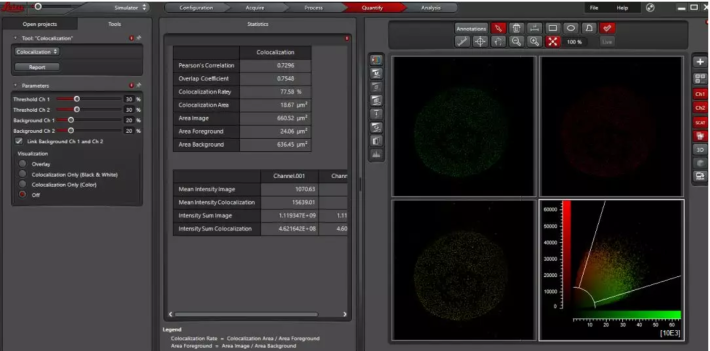
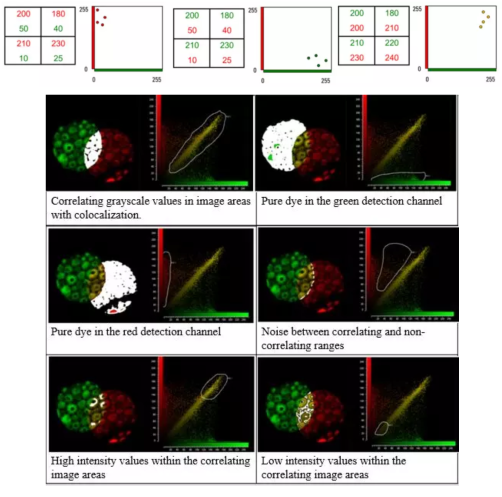
散点图Cytofluorogram:两荧光通道中荧光信号的空间分布和荧光强度的二维散点图,如x轴为绿色信号,y轴为红色信号,根据每个像素点中红绿两种荧光信号灰度值得到其在图中的坐标,展现分子共定位和相互作用程度。
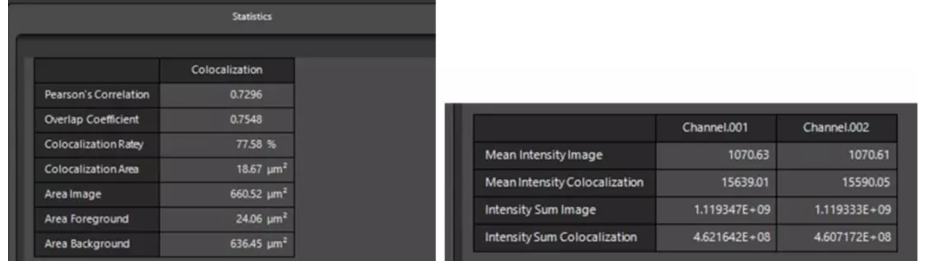
3 Statistics里面即显示共定位分析结果:Pearson's Correlation,Overlap Coefficient,Colocalization Rate等。既可以对整张图进行分析,也可以使用区域选择工具圈出感兴趣区域ROI进行分析。

4 Parameters 为了得到更准确的结果,可以进行相关的参数设置。
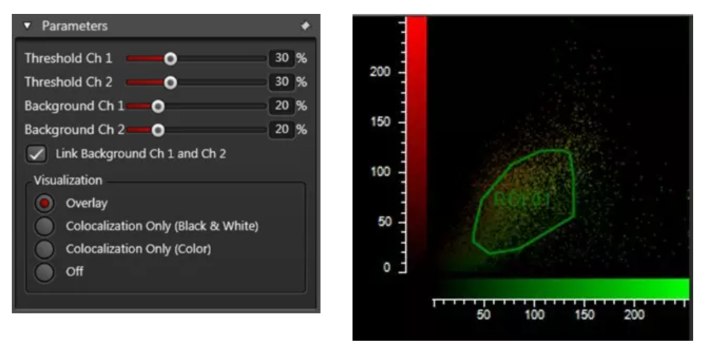
ThresholdCh 1& ThresholdCh 2:灰度值低于设定阈值的像素不纳入共定位分析范围
Background Ch 1 & Background Ch 2:灰度值低于设定阈值的像素作为背景不纳入共定位分析范围。
也可以使用区域选择工具在散点图中圈出共定位分析的灰度值范围。
共定位结果的精准度与图像的分辨率密切相关。但由于衍射极限的存在,常规共聚焦光学分辨率只有200nm左右,如果是观察大于200nm的结构当然轻松,也很容易就能准确判断其共定位程度,但细胞内的亚细胞器、蛋白结构等尺寸往往更小,我们如果需求更精准的结果就需要选择与之匹配的超高分辨率成像技术:如达到120nm的高分辨率LIGHTNING技术,达到30~50nm的超高分辨率STED技术(图2)等。随着分辨率的提高我们可以看到的结构越来越精细,得到的共定位结果当然越来越准确。所以在进行共定位实验时我们可以尽量选择更高分辨率的成像方式。

此外在样品准备和采图时:
1) 串色会严重干扰到共定位结果的准确性,所以实验时可尽量选择串色较少的染料组合以避免串色带来的干扰;如果选择的染料串色,采图时也可以优化调节检测范围以排除串色干扰,当然也可以使用序列扫描的方式。
2) 采图时尽量选择高数值孔径的物镜以获取最优分辨率,同时注意采样频率需要满足Nyquist采样定理(可通过Optimize xy-Format功能来调节format实现),从而得到与最优分辨率匹配的pixel size,以避免采样频率不足导致的信息丢失,以及采样频率过高可能引起的光漂白。
3) 采图时确保各荧光通道不过曝,尽量获取信噪比好的图像。优异的原始数据是后期定量分析和去卷积处理的最佳保障。
4) 采图后可进行去卷积处理(如Huygens或者HyVolution中的deconvolution)以获取信噪比、分辨率更好的数据,得到更准确的共定位分析结果。
5) 共定位分析有多种分析算法,如Pearson's Correlation,Overlap Coefficient,Colocalization Rate等,每种算法都有各自的特点和最佳适用情况,所以我们需要根据具体情况来选择,或者采用结合多种算法结果来分析【1】【2】【3】。
最后,祝大家可以轻松愉快地做好共定位分析实验啦。